【医学影像 AI】基于CNN的FEVR与ROP病变的血管特征分析
本研究应用深度学习网络定量分析家族性渗出性玻璃体视网膜病变(FEVR)与早产儿视网膜病变(ROP)的血管特征。应用人工智能自动血管提取技术,量化比较了ROP、FEVR与健康足月婴儿的眼底血管形态特征。基于深度学习的血管形态定量分析可为FEVR与ROP的鉴别诊断提供客观依据。
【医学影像 AI】基于深度卷积神经网络的FEVR与ROP病变的血管特征分析
0. 论文简介
0.1 基本信息
2023年 中科大 Mingzhai Sun、浙江大学 Lingzhi Cai 等 在 Front Pediatr 发表论文 “基于深度卷积神经网络的家族性渗出性玻璃体视网膜病变与早产儿视网膜病变血管特征分析(Vessels characteristics in familial exudative vitreoretinopathy and retinopathy of prematurity based on deep convolutional neural networks)”。
论文下载: Frontiers, PubMed
引用格式: Deng X, Chen K, Chen Y, Xiang Z, Zhang S, Shen L, Sun M, Cai L. Vessels characteristics in familial exudative vitreoretinopathy and retinopathy of prematurity based on deep convolutional neural networks. Front Pediatr. 2023 Aug 24;11:1252875. doi: 10.3389/fped.2023.1252875.
0.2 摘要
目的: 本研究旨在应用人工智能深度学习网络,定量分析新生儿早产儿视网膜病变(ROP)与家族性渗出性玻璃体视网膜病变(FEVR)的视网膜血管形态学特征。
方法: 采集以视盘为中心的130度标准新生儿眼底照片,通过深度学习网络实现视网膜血管及视盘(OD)的自动分割。基于血管分割结果,量化评估无血管区面积、血管分支角度、血管密度、分形维度(FD)及迂曲度等形态学参数。
结果: 研究纳入FEVR患者201眼、ROP患者289眼及健康对照195眼。血管分割深度学习系统的敏感度为72%,特异度达99%。FEVR组的血管分支角度显著小于正常组和ROP组(37.43±5.43 vs. 39.40±5.61, 39.50±5.58,P=0.001, <0.001)。血管密度参数显示:正常组最低(2.64±0.85),ROP组居中(2.97±0.92),FEVR组最高(3.37±0.88)。分形维度分析表明,对照组显著低于FEVR组和ROP组(0.984±0.039 vs. 1.018±0.039 vs. 1.016±0.044, P<0.001)。血管迂曲度特征表现为ROP组最高(11.61±3.17),FEVR组最僵硬(8.37±2.33),正常组介于两者之间(7.72±1.57)(P<0.001)。
结论: 本研究所采用的深度学习技术能有效实现眼底相血管形态特征的定量分析。FEVR与ROP新生儿患者表现出显著异于健康对照的血管形态学特征,这对ROP与FEVR的临床鉴别诊断具有重要价值。
名词解释:
OD:视盘(optic disc)
ROP:早产儿视网膜病变(retinopathy of prematurity)
FEVR:家族性渗出性玻璃体视网膜病变(familial exudative vitreoretinopathy)
1. 引言
先天性眼病是导致婴幼儿视力丧失及失明的主要原因,这将在全球范围内造成沉重的社会经济负担(1)。婴幼儿先天性视网膜疾病包括早产儿视网膜病变(ROP)、家族性渗出性玻璃体视网膜病变(FEVR)、视网膜母细胞瘤及其他发育异常。
随着极早产儿和极低出生体重儿存活率的提高,ROP的发病率与严重程度也逐年上升。FEVR作为一种遗传性视网膜血管发育疾病,其临床表现与ROP高度相似(2)。与其他发育异常疾病不同,婴幼儿视网膜病变肉眼难以识别,往往进展至晚期才被发现。由于出生后4-6个月是眼球发育的关键期,多数患儿会因此错过最佳治疗时机。因此,早期筛查与诊断对预防婴幼儿视力丧失至关重要。美国儿科学会(AAP)建议对所有胎龄<30周或出生体重<1,500克的婴儿,以及存在额外风险因素的患儿进行筛查(3)。除早产儿筛查外,足月儿的筛查同等重要。
然而,ROP与FEVR在颞侧周边血管形态上具有高度相似性(4)。临床鉴别诊断主要依赖病史和荧光素血管造影(FA)(4,5)。过去十年中,无需麻醉和静脉注射的婴幼儿FA技术逐渐普及,可清晰显示眼底血管特征。通过FA检查,可区分彩色眼底照相和间接检眼镜下难以鉴别的ROP与FEVR病变:前者表现为清晰均一的血管-无血管区分界,后者则多呈现球状血管末端、异常分支模式及静脉-静脉分流(6)。尽管婴幼儿FA已被证实安全有效,但儿科眼科医师的短缺与婴幼儿护理的困难仍构成挑战(7)。
近年来,随着计算机科学和高性能图形处理器的发展,人工智能技术快速进步。人工智能(AI)作为计算机科学的分支,指通过计算机模拟人类智能而仅需最少人工干预的技术(8)。目前大多数研究集中于ROP附加病变的计算机识别与诊断系统。2016年,Worrall等(9)首次应用卷积神经网络(CNNs)自动分析图像特征以实现附加病变的智能诊断。本团队应用CNN深度学习算法分析早产儿眼底图像,实现附加病变自动诊断的敏感度达95.1%,特异度达97.8%(10)。Ye等(11)开发了一种融合深度学习与临床证据的FEVR自动诊断系统,基于超广角眼底图像中视网膜血管特征的定量评估,可对包括早期FEVR在内的病变实现精准无创诊断。
因此,本研究旨在通过人工智能技术定量分析ROP与FEVR患儿的血管形态学特征,以期为这类疾病的鉴别诊断及早期干预提供新见解。
2. 材料与方法
2.1 研究对象
本研究遵循《赫尔辛基宣言》原则,并经浙江省人民医院伦理委员会审查批准。回顾性纳入2022年3月至2023年1月期间眼科门诊确诊的ROP患儿(289眼)和FEVR患儿(201眼),同时选取健康足月儿(195眼)作为对照组。
排除标准包括:存在玻璃体积血、有视网膜激光光凝或玻璃体注药史、以及任何可能影响成像质量的屈光介质混浊。
2.2 眼底成像
所有患儿在散瞳后均接受标准接触式广角眼底成像检查。采集图像尺寸为1600×1200像素,成像角度为130度。以视盘为中心的眼底后极部图像被采集用于分析,以避免不同拍摄角度引入的测量偏差。
2.3 血管特征的人工智能分析
如图1 流程图所示为本研究数据处理流程。视盘分割与血管分割网络的构建方法详见我们先前研究(10)。
- 首先采用基于U-Net的神经网络(12)对视网膜图像进行视盘分割,根据分割结果计算视盘中心并拟合最小外接圆。
- 随后以图像中心为圆心、图像宽度1/4为半径绘制校验圆,筛选视盘中心位于该校验圆内的图像进行基于U-Net的血管分割。
- 以视盘中心为圆心,以视盘最小外接圆半径的2-4倍为半径定义同心圆环状感兴趣区域(ROI),在此区域内完成血管角度、密度、迂曲度及分形维数等定量分析。
- 血管角度
血管角度指血管分叉处两支血管之间的夹角。本研究采用Baker等(13)提出的定义对血管角度进行评估,具体计算分支点处的血管夹角。 - 视网膜血管密度
视网膜血管密度通过血管面积与眼底图像面积的比值进行量化。 - 分形维度
分形维度作为衡量视网膜血管树复杂分支模式的综合指标(14),其数值越高表明血管分支模式越复杂。我们采用Mainster & Martin(15)以及Stosic & Stosic(16)提出的盒计数法计算眼底血管分形维度,该方法通过分析血管段在视网膜图像中的分布特征实现分形维度的量化测量。 - 血管迂曲度
血管迂曲度用于评估血管弯曲程度的参数,数值越大表明血管弯曲程度越高。目前存在多种迂曲度定义方式(17,18),本研究采用Hart等(17)最早提出、后经Turior等(19)改进的"弧长归一化总平方曲率"测量方法,该方法通过对血管段弧长归一化曲率的计算实现更精确的迂曲度评估。
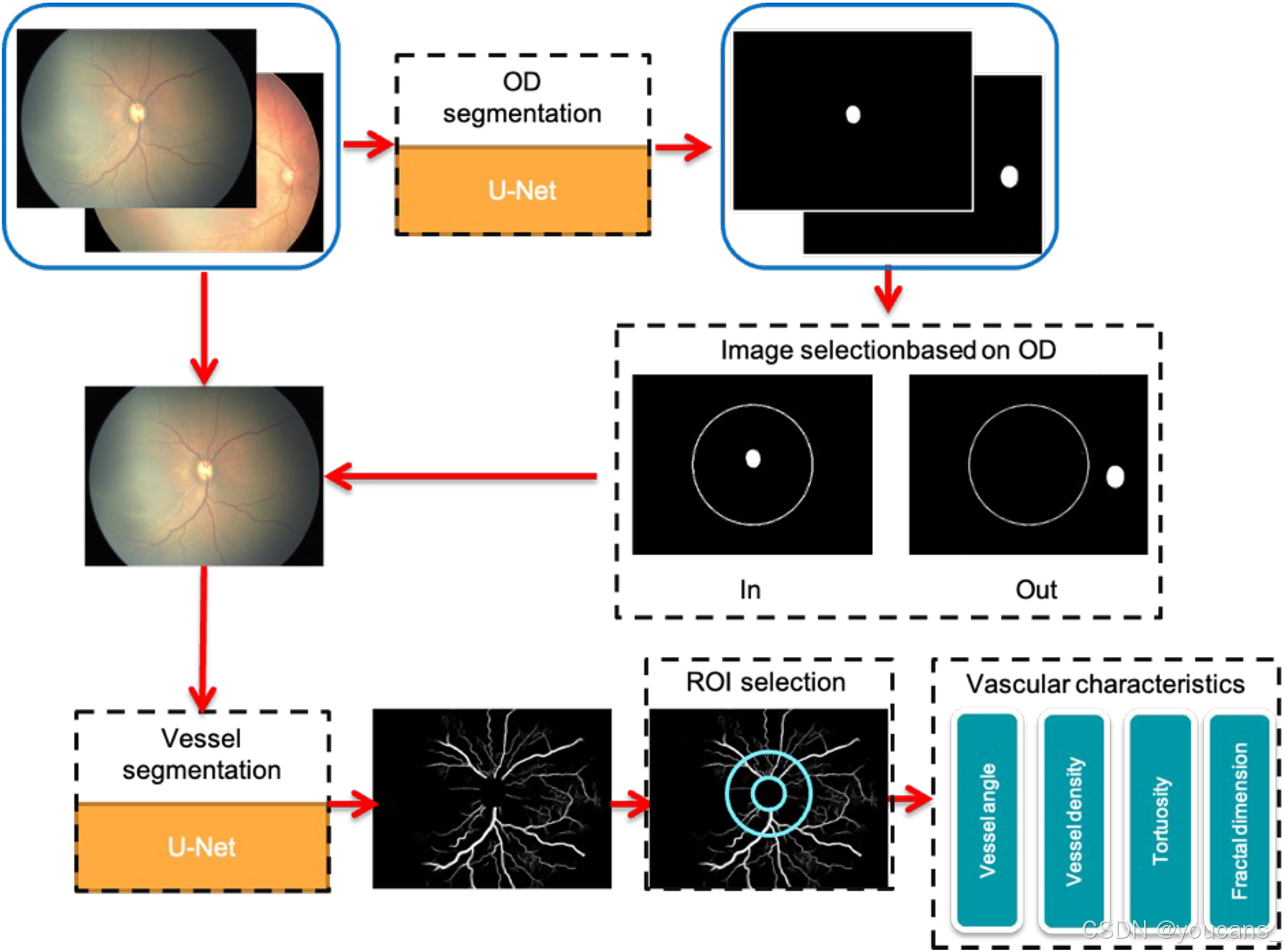
图1:数据流程图解。OD:视盘(Optic Disc);ROI:感兴趣区域(Region of Interest)。
2.4 统计学分析
采用SPSS统计软件(版本26.0,SPSS Inc,美国芝加哥)进行数据分析。计量资料以均数±标准差(mean±SD)表示,各组间血管形态特征比较采用χ²检验或单因素方差分析,以P<0.05为差异具有统计学意义。
3. 结果
3.1 视网膜血管分割性能
三组受试者的视盘及视网膜血管分割结果如图2所示。血管分割的灵敏度为0.72,特异度为0.99;视盘分割的灵敏度为0.94,特异度为0.99。
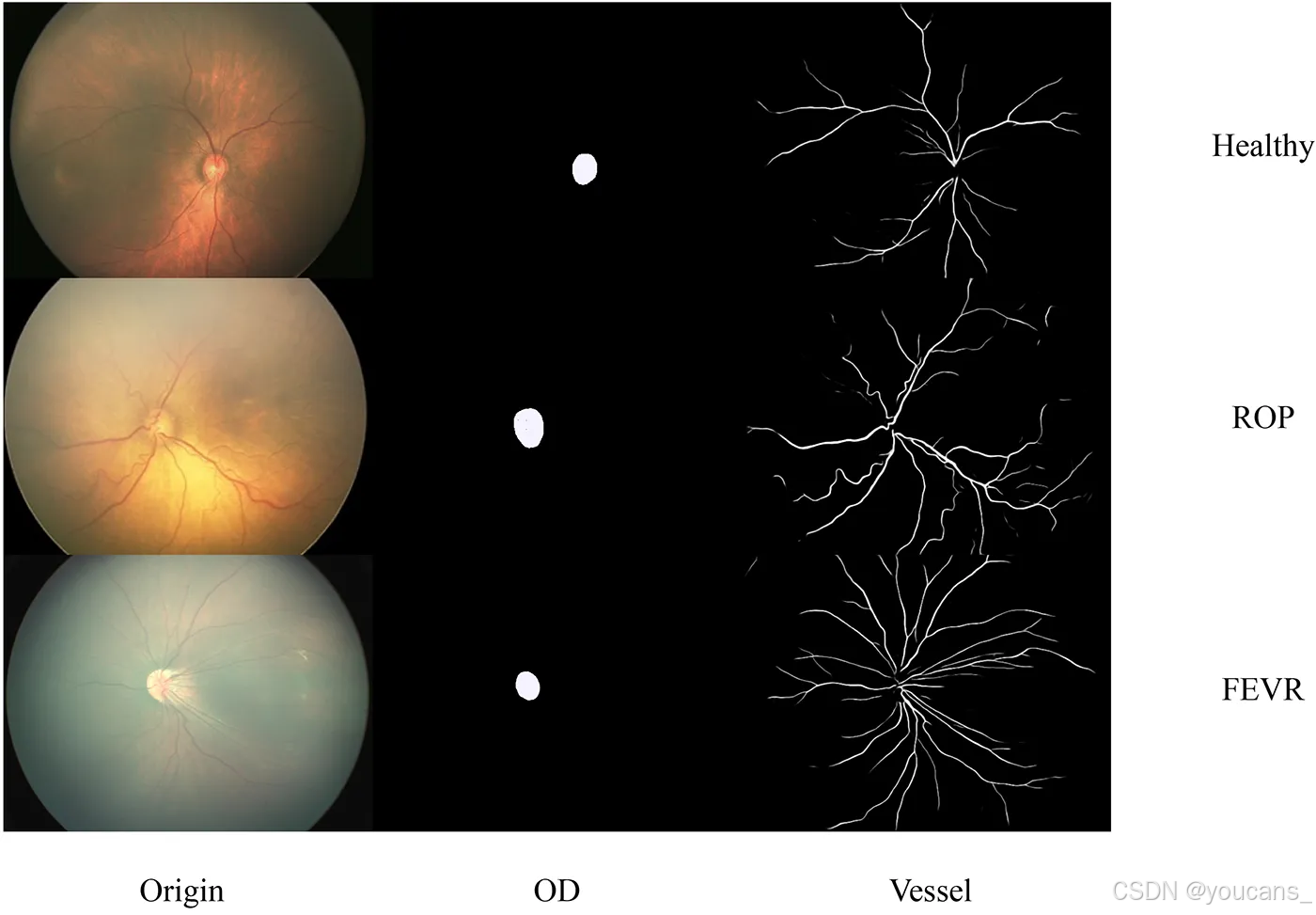
图2:健康眼、早产儿视网膜病变(ROP)眼及家族性渗出性玻璃体视网膜病变(FEVR)眼的原始图像、视盘分割结果与视网膜血管分割结果对比图。
3.2 血管分支角度
三组间血管分支角度差异具有统计学意义(P < 0.001)。FEVR组的血管分支角度显著小于正常组和ROP组(37.43 ± 5.43 vs. 39.40 ± 5.61,39.50 ± 5.58;P = 0.001,P < 0.001),而ROP组与正常组间无显著差异(P = 0.980)。
3.3 血管密度
三组血管密度差异具有统计学意义(P < 0.001)。正常组血管密度最低(2.64 ± 0.85),ROP组居中(2.97 ± 0.92),FEVR组最高(3.37 ± 0.88),组间两两比较均存在显著差异(均P < 0.001)。
3.4 分形维数
三组分形维数差异具有统计学意义(P < 0.001)。正常组分形维数(0.984 ± 0.039)显著小于ROP组(1.018 ± 0.039)和FEVR组(1.016 ± 0.044)(均P < 0.001)。
3.5 血管迂曲度
ROP组的血管迂曲度最高(11.61 ± 3.17),FEVR组最低(7.72 ± 1.57),正常组为8.37 ± 2.33(P < 0.001)。三组血管形态学参数及组间比较结果详见 表1 和 图3。
表1 ROP、FEVR与健康组的临床形态学特征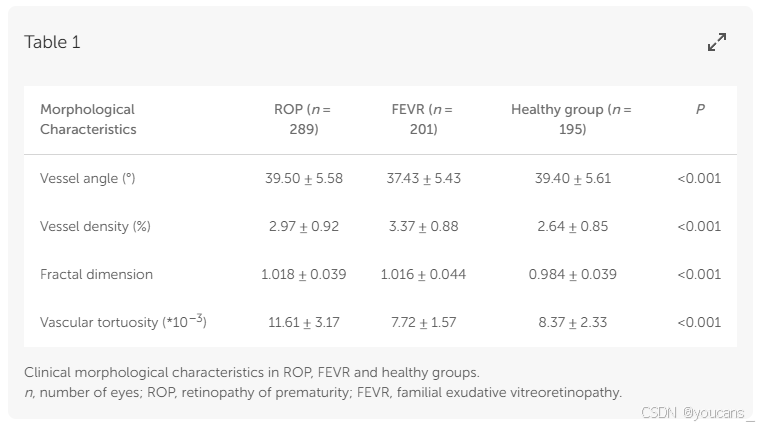
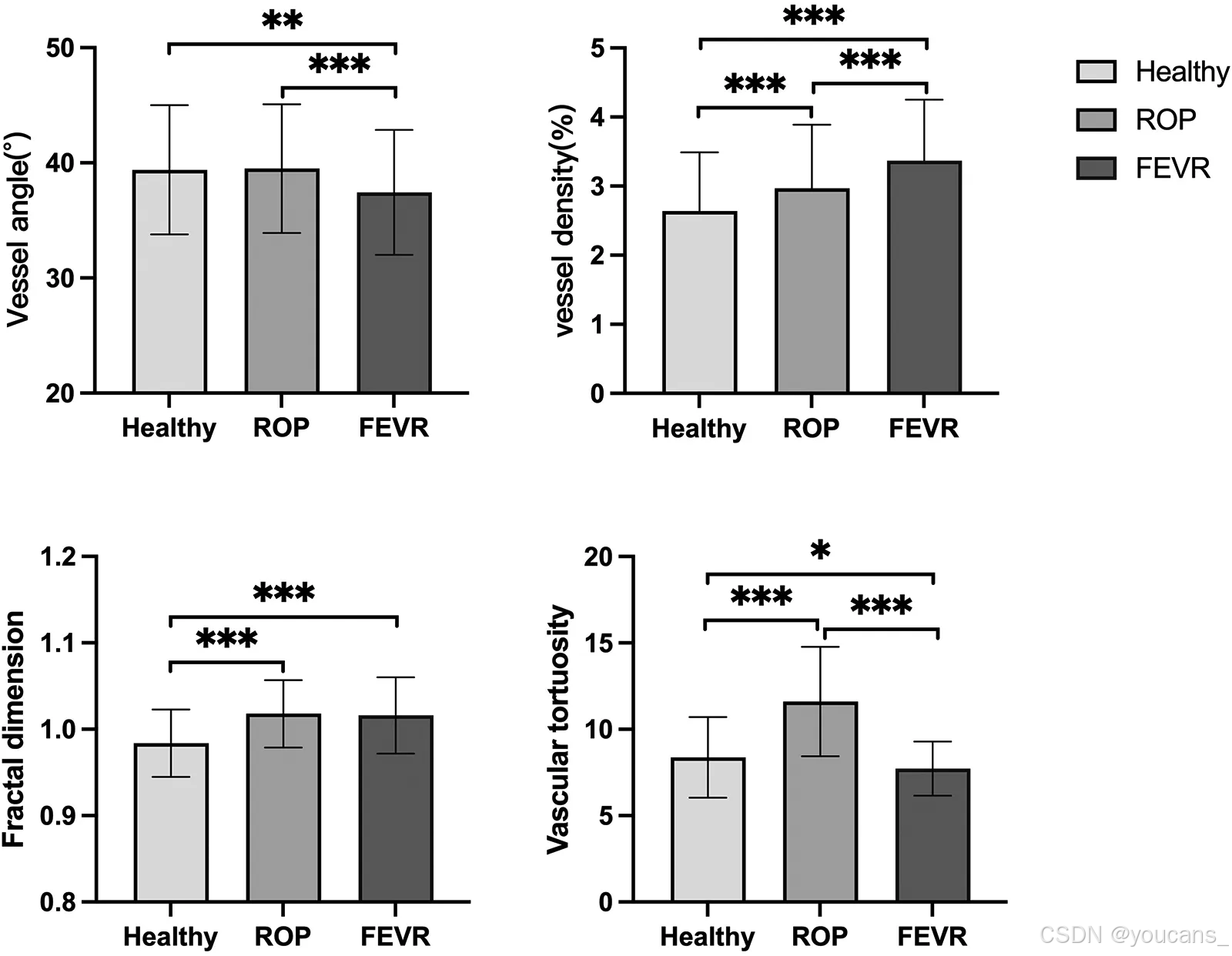
图3:健康组、ROP组和FEVR组血管形态特征的差异性比较。
ROP:早产儿视网膜病变(retinopathy of prematurity)
FEVR:家族性渗出性玻璃体视网膜病变(familial exudative vitreoretinopathy)。
*P < 0.05, **P < 0.01, ***P < 0.001。
4. 讨论
本研究采用深度学习系统自动量化分析ROP、FEVR与足月新生儿眼后节视网膜血管形态。研究表明,三组婴儿在血管角度、血管密度、分形维数和血管迂曲度等形态学参数上均存在显著差异。我们发现ROP与FEVR在血管形态上具有显著区别,可通过人工智能系统进行识别。
**本研究发现FEVR患者眼部血管角度较ROP患者及健康足月婴儿显著减小。**我们认为血管角度的减小可能源于玻璃体视网膜界面牵引力增强。Lee等[20]通过手持OCT分析FEVR患儿图像,发现明显视网膜位移与牵引现象。强粘连玻璃体的收缩会进一步引发特征性黄斑异位和视网膜牵引并发症,这在FEVR幼年患者中尤为显著。此外,Wang等[21]指出超广角OCTA可检测FEVR早期患者颞侧中周部玻璃体视网膜界面异常,这类异常会导致表层视网膜血管拉直及血管角度减小。Shao等[22]通过超广角眼底成像证实FEVR患者视网膜动脉角度减小,这与本研究结果一致。
**本团队前期研究[10]表明,由于ROP视网膜血管的扩张迂曲特性,血管密度随"附加病变"严重程度增加而升高。**然而OCTA研究显示FEVR患者黄斑区浅层与深层毛细血管密度均降低[23,24]。我们推测这种差异源于测量方法及受试者年龄的不同。
**分形维数可量化病理状态下组织结构的细微畸变,已成为神经科学领域的新型生物标志物之一[25]。**在眼科领域,该参数已用于糖尿病视网膜病变等疾病的早期检测[26]。研究表明分形维数会随糖尿病视网膜病变严重程度增加而升高[27]。本研究首次将分形维数应用于婴儿眼底成像的视网膜血管复杂度量化,结果显示FEVR与ROP婴儿的视网膜血管复杂度均高于健康足月婴儿。
FEVR患儿视网膜颞侧牵引会导致血管拉直。Hsu等[24]在FEVR患者的OCTA成像中观察到黄斑区血管拉直现象。Chen等[28]研究发现,98.4%的无症状轻度FEVR患者眼底成像呈现血管分支增多及周边血管分支拉直,这与我们前期研究结果[11]相符。血管内皮生长因子(VEGF)是ROP病理性血管生成的主要介质[29]。Liang等研究发现房水VEGF水平升高与Ⅰ区ROP严重程度及静脉迂曲度呈正相关[29]。另有研究提出采用婴儿眼底图像的平均及最大血管迂曲度预测ROP治疗需求,具有较高灵敏度与特异度[30]。Chen等[31]指出玻璃体腔注射抗VEGF药物后血管迂曲度的变化可提示ROP病灶再激活风险。因此我们认为FEVR与ROP婴儿视网膜血管迂曲度的相反趋势反映了两者不同的病理过程。
本研究存在若干局限性:首先,回顾性研究设计存在固有局限;其次,人工智能血管提取技术对重度ROP合并FEVR的视网膜血管提取能力有限,可能造成选择偏倚;此外,相比成人,婴儿眼底图像更难获取且质量较差(表现为对比度低、照明不均及血管纤细),导致血管分割效果欠佳。我们期待未来人工智能血管提取算法与性能的改进,以实现更深入全面的分析。
综上所述,本研究应用人工智能自动血管提取技术,量化比较了ROP、FEVR与健康足月婴儿的眼底血管形态特征。三组在血管角度、密度、分形维数和迂曲度等方面均存在差异。结合人工智能血管提取能力,这些肉眼难以识别的血管形态特征将有助于儿科眼科医师对两种疾病进行鉴别诊断。
5. 声明
数据可及性声明
支持本文结论的原始数据将由作者在合理要求下提供,无不当保留。
伦理声明
本研究遵循《赫尔辛基宣言》,并获浙江省人民医院伦理审查委员会批准。所有参与者的法定监护人均签署书面知情同意书。
## 8. 参考文献
1. Tang H, Li N, Li Z, Zhang M, Wei M, Huang C, et al. Fundus examination of 199 851 newborns by digital imaging in China: a multicentre cross-sectional study. Br J Ophthalmol. (2018) 102(12):1742–6. doi: 10.1136/bjophthalmol-2018-312366
2. Miyakubo H, Hashimoto K, Miyakubo S. Retinal vascular pattern in familial exudative vitreoretinopathy. Ophthalmology. (1984) 91(12):1524–30. doi: 10.1016/S0161-6420(84)34119-7
3. Fierson WM; American Academy of Pediatrics Section on Ophthalmology; American Academy of Ophthalmology; American Association for Pediatric Ophthalmology and Strabismus; American Association of Certified Orthoptists. Screening examination of premature infants for retinopathy of prematurity. Pediatrics. (2018) 142(6):e20183061. doi: 10.1542/peds.2018-3061
4. John VJ, McClintic JI, Hess DJ, Berrocal AM. Retinopathy of prematurity versus familial exudative vitreoretinopathy: report on clinical and angiographic findings. Ophthalmic Surg Lasers Imaging Retina. (2016) 47(1):14–9. doi: 10.3928/23258160-20151214-02
5. Kartchner JZ, Hartnett ME. Familial exudative vitreoretinopathy presentation as persistent fetal vasculature. Am J Ophthalmol Case Rep. (2017) 6:15–7. doi: 10.1016/j.ajoc.2017.01.001
6. Kashani AH, Brown KT, Chang E, Drenser KA, Capone A, Trese MT. Diversity of retinal vascular anomalies in patients with familial exudative vitreoretinopathy. Ophthalmology. (2014) 121(11):2220–7. doi: 10.1016/j.ophtha.2014.05.029
7. Kvopka M, Chan W, Lake SR, Durkin S, Taranath D. Fundus fluorescein angiography imaging of retinopathy of prematurity in infants: a review. Surv Ophthalmol. (2023) 68(5):S0039625723000735. doi: 10.1016/j.survophthal.2023.05.004
8. Bini SA. Artificial intelligence, machine learning, deep learning, and cognitive computing: what do these terms mean and how will they impact health care? J Arthroplasty. (2018) 33(8):2358–61. doi: 10.1016/j.arth.2018.02.067
9. Worrall DE, Wilson CM, Brostow GJ. Automated retinopathy of prematurity case detection with convolutional neural networks. In: Carneiro G, Mateus D, Peter L, Bradley A, Tavares JMRS, Belagiannis V, editors. Deep learning and data labeling for medical applications. Cham: Springer International Publishing (2016). p. 68–76.
10. Mao J, Luo Y, Liu L, Lao J, Shao Y, Zhang M, et al. Automated diagnosis and quantitative analysis of plus disease in retinopathy of prematurity based on deep convolutional neural networks. Acta Ophthalmol. (2020) 98(3):e339–45. doi: 10.1111/aos.14264
11. Ye Y, Mao J, Liu L, Zhang S, Shen L, Sun M. Automatic diagnosis of familial exudative vitreoretinopathy using a fusion neural network for wide-angle retinal images. IEEE Access. (2020) 8:162–73. doi: 10.1109/ACCESS.2019.2961418
12. Ronneberger O, Fischer P, Brox T. U-Net: convolutional networks for biomedical image segmentation. In: Navab N, Hornegger J, Wells WM, Frangi AF, editors. Medical image computing and computer-assisted intervention – MICCAI 2015. Munich, Germany: Springer International Publishing (2015). p. 234–41. (Lecture Notes in Computer Science; vol. 9351).
13. Baker ML, Hand PJ, Wang JJ, Wong TY. Retinal signs and stroke: revisiting the link between the eye and brain. Stroke. (2008) 39(4):1371–9. doi: 10.1161/STROKEAHA.107.496091
14. Liew G, Wang JJ, Cheung N, Zhang YP, Hsu W, Lee ML, et al. The retinal vasculature as a fractal: methodology, reliability, and relationship to blood pressure. Ophthalmology. (2008) 115(11):1951–6.e1. doi: 10.1016/j.ophtha.2008.05.029
15. Mainster MA. The fractal properties of retinal vessels: embryological and clinical implications. Eye. (1990) 4(1):235–41. doi: 10.1038/eye.1990.33
16. Stosic T, Stosic BD. Multifractal analysis of human retinal vessels. IEEE Trans Med Imaging. (2006) 25(8):1101–7. doi: 10.1109/TMI.2006.879316
17. Hart WE, Goldbaum M, Côté B, Kube P, Nelson MR. Measurement and classification of retinal vascular tortuosity. Int J Med Inf. (1999) 53(2–3):239–52. doi: 10.1016/S1386-5056(98)00163-4
18. Smedby O, Högman N, Nilsson S, Erikson U, Olsson AG, Walldius G. Twodimensional tortuosity of the superficial femoral artery in early atherosclerosis. J Vasc Res. (1993) 30(4):181–91. doi: 10.1159/000158993
19. Turior R, Onkaew D, Uyyanonvara B, Chutinantvarodom P. Quantification and classification of retinal vessel tortuosity. Scienceasia. (2013) 39265(39):265–77. doi: 10. 2306/scienceasia1513-1874.2013.39.265
20. Lee J, El-Dairi MA, Tran-Viet D, Mangalesh S, Dandridge A, Jiramongkolchai K, et al. Longitudinal changes in the optic nerve head and retina over time in very young children with familial exudative vitreoretinopathy. Retina. (2019) 39(1):98–110. doi: 10.1097/IAE.0000000000001930
21. Wang Y, Lai Y, Zhou X, Zhang T, Sun L, Zhang Z, et al. Ultra-widefield optical coherence tomography angiography in mild familial exudative vitreoretinopathy. Retina. (2023) 43(6):932–9. doi: 10.1097/IAE.0000000000003754
22. Shao Y, Mao J, Fang Y, Chen Y, Zhang Z, Xiang Z, et al. The characteristic of optical coherence tomography angiography and retinal arteries angle in familial exudative vitreoretinopathy with inner retinal layer persistence. Curr Eye Res. (2023)48(9):1–7. doi: 10.1080/02713683.2023.2213867
23. Koulisis N, Moysidis SN, Yonekawa Y, Dai YL, Burkemper B, Wood EH, et al. Correlating changes in the macular microvasculature and capillary network to peripheral vascular pathologic features in familial exudative vitreoretinopathy. Ophthalmology Retina. (2019) 3(7):597–606. doi: 10.1016/j.oret.2019.02.013
24. Hsu ST, Finn AP, Chen X, Ngo HT, House RJ, Toth CA, et al. Macular microvascular findings in familial exudative vitreoretinopathy on optical coherence tomography angiography. Ophthalmic Surg Lasers Imaging Retina. (2019) 50 (5):322–9. doi: 10.3928/23258160-20190503-11
25. Ziukelis ET, Mak E, Dounavi ME, Su L, O’Brien JT. Fractal dimension of the brain in neurodegenerative disease and dementia: a systematic review. Ageing Res Rev. (2022) 79:101651. doi: 10.1016/j.arr.2022.101651
26. Yu S, Lakshminarayanan V. Fractal dimension and retinal pathology: a metaanalysis. Appl Sci. (2021) 11(5):2376. doi: 10.3390/app11052376
27. Hashmi S, Lopez J, Chiu B, Sarrafpour S, Gupta A, Young J. Fractal dimension analysis of OCTA images of diabetic retinopathy using circular mass-radius method. Ophthalmic Surg Lasers Imaging Retina. (2021) 52(3):116–22. doi: 10.3928/23258160-20210302-01
28. Chen C, Sun L, Li S, Huang L, Zhang T, Wang Z, et al. The spectrum of genetic mutations in patients with asymptomatic mild familial exudative vitreoretinopathy. Exp Eye Res. (2020) 192:107941. doi: 10.1016/j.exer.2020.107941
29. Chen J, Smith LEH. Retinopathy of prematurity. Angiogenesis. (2007) 10 (2):133–40. doi: 10.1007/s10456-007-9066-0
30. Lertjirachai I, Stem MS, Moysidis SN, Koulisis N, Capone A, Drenser KA, et al. Vessel tortuosity cutoff values using the modified ROPtool may predict need for treatment in retinopathy of prematurity. Ophthalmic Surg Lasers Imaging Retina. (2019) 50(4):215–20. doi: 10.3928/23258160-20190401-03
31. Chen TA, Shields RA, Bodnar ZH, Callaway NF, Schachar IH, Moshfeghi DM. A spectrum of regression following intravitreal bevacizumab in retinopathy of prematurity. Am J Ophthalmol. (2019) 198:63–9. doi: 10.1016/j.ajo.2018.09.039
版权说明:
本文由 youcans@xidian 对论文【Vessels characteristics in familial exudative vitreoretinopathy and retinopathy of prematurity based on deep convolutional neural networks】进行摘编和翻译。该论文版权属于原文期刊和作者,本译文只供研究学习使用。
youcans@xidian 作品,转载必须标注原文链接:
【医学影像 AI】基于深度卷积神经网络的FEVR与ROP病变的血管特征分析(https://youcans.blog.csdn.net/article/details/151361313)
Crated:2025-09
更多推荐
 已为社区贡献12条内容
已为社区贡献12条内容








所有评论(0)