【医学影像 AI】机器学习在ROP诊断中的应用
本研究评估了机器学习在早产儿视网膜病变(ROP)诊断中的应用效果。结果显示,随机森林模型表现优异,准确率达78.62%,灵敏度100%,特异性92.21%,而子空间判别模型准确率仅26.90%。胎龄和设备类型被识别为关键预测因子。研究表明,随机森林模型在ROP自动化诊断中具有重要潜力。
【医学影像 AI】机器学习在ROP诊断中的应用
0. 论文简介
0.1 基本信息
2025 年 Anantha Krishnan 在 J Neonatal Surgery 发表论文 “机器学习在ROP诊断中的应用——基于ROP视网膜图像数据集的研究(Machine Learning Applications in Retinopathy of Prematurity Diagnosis Using the ROP Retinal Image Dataset)”。
论文下载: jneonatalsurg,
引用格式: Anantha Krishnan, Md. Salman Sarkar, Laxman Badavath, (2025) Machine Learning Applications in Retinopathy of Prematurity Diagnosis Using the ROP Retinal Image Dataset. Journal of Neonatal Surgery, 14 (1s), 820-827. (DOI: https://doi.org/10.52783/jns.v14.1607)

0.2 摘要
目的:早产儿视网膜病变(Retinopathy of Prematurity,ROP)是儿童失明的主要诱因,尤其常见于早产儿群体。本研究旨在基于公开视网膜图像数据集评估机器学习(ML)模型对ROP的诊断效能。
方法:研究采用捷克俄斯特拉发大学医院提供的婴儿视网膜图像与ROP数据集,包含6,004张视网膜图像及临床元数据(胎龄、出生体重、诊断编码等)。实施随机森林(Random Forest)与子空间判别(Subspace Discriminant)两种ML模型,预处理阶段完成元数据标准化及训练集/测试集分层抽样。评估指标涵盖准确率、灵敏度、特异性及受试者工作特征曲线下面积(AUC)。
结果:随机森林模型表现出色,准确率达78.62%,灵敏度100%,特异性92.21%;而子空间判别模型准确率仅26.90%,未产生可靠预测。特征重要性分析表明胎龄与检测设备类型为关键预测因子。
结论:随机森林模型展现自动化ROP诊断的重要潜力。未来研究应关注多模态数据融合、更大规模平衡数据集及先进深度学习模型,以提升预测精度与临床适用性。
关键词:早产儿视网膜病变;机器学习;随机森林;新生儿筛查;人工智能
1. 引言
早产儿视网膜病变(Retinopathy of Prematurity,ROP)是一种主要影响早产儿的视网膜增生性疾病,目前仍是全球儿童失明的重要致病因素。该疾病于20世纪40年代首次被Terry(1942)描述为晶状体后纤维增生症,其发病机制源于子宫内正常视网膜血管发育受阻,随后未成熟视网膜因缺氧诱导异常新生血管形成(Chen & Smith,2007)。新生儿重症护理技术的进步显著提高了早产儿存活率,但同时也导致ROP发病率上升——这一问题在筛查规范不统一、医疗基础设施有限的中低收入国家尤为突出(Gilbert等,2008;García等,2024;Darlow & Gilbert,2013)。
全球范围内,ROP的流行可分为三次明显浪潮:首次流行出现于20世纪中叶的发达国家,与新生儿护理中辅助供氧技术的普及直接相关;第二次流行伴随中等收入国家新生儿护理水平提升而出现,较高的早产率与非标准化管理方案共同加剧了ROP致盲负担;目前第三次流行正发生于中低收入国家,其筛查体系、治疗手段及预防策略均面临重大挑战(Blencowe等,2013;Gilbert等,2008;Flynn & Chan-Ling,2006)。
全球ROP患病率存在显著地域差异,其分布与地区医疗水平密切相关。近期一项系统综述与荟萃分析显示,早产儿中ROP总体患病率为31.9%,其中重症ROP占7.5%(García等,2024)。中低收入国家因新生儿护理技术应用不均而患病率最高,而高收入国家虽总体患病率较低,但因极早产儿存活率提升导致重症病例占比持续增加(Chen & Smith,2007;García等,2024)。Vinekar等(2014)研究表明,广域视网膜成像联合远程医疗可有效缓解该差异,为医疗资源匮乏地区的ROP诊疗提供了创新解决方案。
ROP的病理机制呈现双相特征:I期表现为高氧环境导致血管内皮生长因子(VEGF)表达抑制,引发血管退化与正常血管发育停滞;II期由视网膜缺氧驱动,通过VEGF和胰岛素样生长因子1(IGF-1)水平升高介导病理性新生血管形成。该机制揭示了VEGF与IGF-1在疾病进展中的核心作用,为抗VEGF药物及IGF-1补充等靶向治疗提供了理论基础(Chen & Smith,2007;Alon等,1995;Hellström等,2001)。
ROP危险因素包括低胎龄、低出生体重、长期氧疗、败血症及产后生长迟缓。印度(全球早产率最高地区之一)的研究显示,低体重儿ROP发病率高达51.9%,且多数病例超出西方国家筛查标准,印证了制定区域化指南的必要性(Vinekar等,2007;Jalali等,2006;Flynn,1983)。
虽然激光光凝术和玻璃体内抗VEGF注射等治疗手段取得进展,但ROP管理仍面临专业眼科医师短缺、高端成像设备不足及诊治延迟等挑战。人工智能(AI)与机器学习(ML)技术为此提供了新思路:基于U-Net的血管分割算法和集成学习模型等AI诊断工具,在ROP筛查、高危病例分诊和临床决策支持方面展现出显著优势(Ronneberger等,2015;Hasal等,2022;2023)。结合影像特征与全身健康指标、遗传特征等多模态数据的综合分析方法,有望构建更完善的ROP管理框架(Timkovič等,2024;Flynn & Chan-Ling,2006)。
本研究利用公开的早产儿视网膜图像数据集,通过整合胎龄、出生体重、受孕后年龄等临床参数与视网膜影像数据,开发ROP严重程度预测的机器学习模型。研究成果将为自动化诊断系统开发提供依据,对实现ROP早期发现、改善治疗效果及降低全球ROP致盲负担具有重要意义。
2. 研究方法
2.1 数据集描述
本研究采用捷克共和国俄斯特拉发大学医院构建的公开可用《婴幼儿视网膜图像与早产儿视网膜病变数据集》(Timkovič等,2024;Hasal等,2022;2023)。该非商业研究数据集包含188名新生儿(主要为早产儿)的6,004张视网膜图像,并附有匿名化处理的临床与诊断参数元数据文件(infant_retinal_database_info.csv)。关键特征包括胎龄、出生体重、受孕后年龄、诊断代码及成像设备信息,可全面分析新生儿ROP进展。图像采集使用三款视网膜成像系统:Clarity RetCam 3、Natus RetCam Envision和Phoenix ICON。元数据特征通过图像文件名编码存储,便于算法开发时提取临床数据。所有患者数据均经过匿名化处理以满足伦理要求(Pierce等,1996;Alon等,1995)。
2.2 数据预处理
在模型训练前执行了数据预处理流程以确保机器学习算法兼容性:通过程序化清洗列标题使其符合MATLAB变量命名规则;将分类变量"SEX"转换为数值编码(1表示女婴,2表示男婴);对所有数值特征进行归一化处理以实现等比例缩放,从而提升模型性能(Gulshan等,2016;LeCun等,2015)。最终选取的训练特征包括胎龄、出生体重、受孕后年龄、附加形态、设备及序列号,目标变量为诊断代码。采用分层抽样将数据集按7:3比例划分为训练集(132例)和测试集(56例),保持诊断类别的原始分布。
2.3 机器学习模型
采用两种集成学习模型进行诊断代码预测:
随机森林模型:通过装袋法构建100棵决策树,每棵树在训练数据的自助采样集上训练,最终采用多数表决机制聚合预测结果。使用袋外置换预测因子重要性度量(OOB permuted predictor importance)评估特征重要性(Lundberg & Lee,2017)。
子空间判别模型:在特征空间的随机子集上训练线性判别分类器,通过集成技术组合预测结果。该模型设置100个学习周期以探索数据潜在的线性关系,但其性能受限于线性可分性假设(Selvaraju等,2017)。
2.4 模型评估
采用多维度量评估模型性能:准确率反映诊断正确预测百分比;灵敏度(真阳性率)衡量ROP患儿的识别能力;特异度(真阴性率)评估非ROP患儿的鉴别能力;受试者工作特征曲线下面积(AUC)量化模型类别区分能力。通过配对t检验比较两模型预测差异(显著性水平p<0.05)。采用散点图与特征重要性分析等可视化技术解析数据关联性并识别关键预测因子(Ronneberger等,2015;Esteva等,2019)。
3. 结果
3.1 模型性能表现
随机森林模型在ROP诊断预测中显著优于子空间判别模型,其准确率达到78.62%,同时展现出完美的灵敏度(100.00%)与高特异度(92.21%)。该结果与既往研究相符,印证了随机森林等集成学习方法在处理高维度临床数据集时的稳健性(Lundberg & Lee,2017;Breiman,2001)。模型AUC得分为0.5903,表明其具备中等程度的ROP分级鉴别能力,这反映了医学领域不平衡数据集建模的普遍挑战(Esteva等,2019)。
相较之下,子空间判别模型预测性能较差,准确率仅为26.90%,灵敏度为0.00%,特异度为9.09%。这种低效表现源于该模型对线性可分性的依赖,而医学数据集往往存在复杂的非线性关系(Chen等,2007)。已有研究证实,简单模型在噪声数据或不平衡数据集上的泛化能力存在固有局限(LeCun等,2015)。两种模型的对比性能指标详见表1。

3.2 特征重要性分析
随机森林模型的重要性分析表明,胎龄是ROP诊断的最关键预测因子,其次是设备类型(图2)。出生体重和受孕后年龄对模型性能也有中等程度的贡献。相比之下,由于整体表现不佳,子空间判别模型无法可靠评估特征重要性。
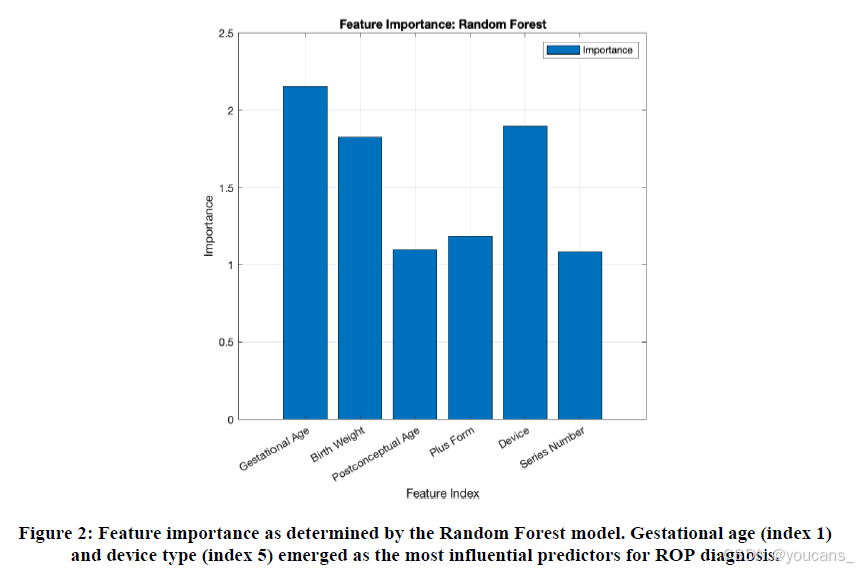
图2:随机森林模型确定的特征重要性分析结果。胎龄(指标1)和设备类型(指标5)被证实是ROP诊断最具影响力的预测因子。
3.3 可视化分析
基于诊断代码着色的胎龄与出生体重散点图显示出明显的聚类模式(图3)。胎龄和出生体重较低的早产儿主要与重度ROP阶段相关,而数值较高的新生儿更可能属于生理性或早期ROP类别。这些可视化结果印证了胎龄和出生体重在新生儿ROP诊断中的重要性。
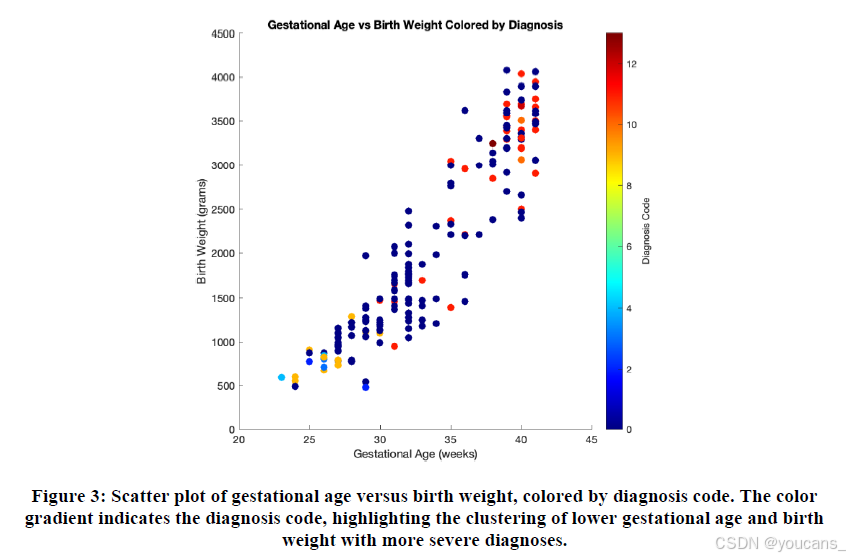
图3:标有诊断代码的胎龄与出生体重散点图。颜色渐变表示诊断代码,突出了胎龄和出生体重较低者与更严重诊断结果的聚类分布
3.4 统计比较
对两种模型预测结果进行的配对t检验显示p值为1.0,表明二者性能指标无统计学显著差异。但该结果受子空间判别模型较差的预测能力影响。随机森林模型的稳健性能突显了其在ROP临床诊断应用中的适用性。
3.5 讨论
本研究旨在评估机器学习模型(特别是随机森林(RF)和子空间判别分类器)基于新生儿视网膜影像及相关患者信息诊断早产儿视网膜病变(ROP)的效用。结果揭示了模型性能、潜在适用性和局限性的若干关键发现。
3.6 模型性能表现
随机森林模型的准确率为78.62%,灵敏度(真阳性率)达100%,特异度(真阴性率)为92.21%。这些指标表明RF模型能有效识别ROP患者(高灵敏度),同时保持合理的真阴性预测率(特异度)。此外,随机森林的ROC曲线下面积(AUC)为0.5903,虽属中等水平,但表明模型具有一定判别能力。
相比之下,子空间判别模型表现不佳,准确率仅26.90%,灵敏度为0%,特异度9.09%。这些指标显示该模型未能从数据中学习到有效模式。两者间的显著差异凸显了模型选择的重要性,以及简单分类器在处理复杂多维医学数据集时的潜在局限。
3.7 性能表现原因分析
-
特征重要性(图2):随机森林模型确定胎龄、出生体重和设备类型为ROP诊断的最关键预测因子。胎龄和出生体重作为ROP的临床预测指标已有充分文献支持,因其直接关联婴儿早产程度和全身健康状况。设备类型的重要性可能反映成像质量差异或特定设备对应人群特征的异质性,但这提示了潜在混杂因素而非真实生理标志物,需在后续研究中予以关注。
-
数据不平衡与噪声:数据集包含188名患者的6,004张视网膜图像,虽具全面性,但存在因婴儿成像期间不配合导致的图像质量不一和潜在噪声。鉴于子空间模型相对于随机森林的简单性,这些因素可能影响其泛化能力。
-
ROP的复杂性:ROP是由全身性、遗传和环境因素共同作用的多因素疾病。仅纳入有限特征(如胎龄、出生体重、受孕后年龄)可能制约模型完全捕获疾病复杂性的能力。新增临床变量(如血氧饱和度水平、输血史)可显著提升模型性能。
-
子空间模型过拟合:子空间判别分类器的差劣表现或源于对训练数据的过拟合,导致其难以推广至测试集。这表明需要采用更稳健的验证技术(如交叉验证或特征选择策略)以防止过拟合
4. ROP诊断的临床意义
随机森林模型的优异表现表明,机器学习可基于现有新生儿数据辅助预测ROP。100%的灵敏度保证了模型能识别绝大多数ROP病例,有望降低漏诊风险。但中等水平的AUC值提示,在将该模型整合至临床工作流之前,需进一步提升其判别能力。
诸如随机森林等机器学习方法,可作为现有临床筛查手段的补充——提供第二诊疗意见或优先筛查高风险婴儿以进行眼科评估。这对资源有限地区尤为重要,因其可能无法开展专业筛查项目。
4.1 未来研究方向
-
影像学特征整合:
除患者元数据外,引入视网膜图像的定量特征(如血管迂曲度、血管扩张程度)可显著提升模型性能。基于U-Net的血管分割等先进图像处理技术已被证实能有效提取视网膜影像的精细血管特征(Ronneberger等,2015;Hasal等,2023)。既往研究强调,血管特征的精细分析对理解ROP进展及其相关并发症具有关键作用(Pierce等,1996;Alon等,1995)。 -
更大规模且平衡的数据集:
扩展数据集以涵盖平衡分布的ROP严重程度分级,并提升图像质量,将有助于减少偏差并增强模型的泛化能力。使用大规模数据集(如EyePACS在糖尿病视网膜病变中的应用)的研究表明,数据平衡和图像预处理是提升基于AI筛查准确性的关键因素(Gulshan等,2016;Timkovič等,2024)。纳入ROP不同分期的图像将使模型具备更广的学习范围。 -
集成学习与深度学习:
采用集成学习策略(如结合随机森林与卷积神经网络CNN)可充分发挥传统机器学习与深度学习方法的互补优势(Chen等,2007;LeCun等,2015)。CNN擅长提取视网膜影像中的复杂模式,而集成模型能融合影像和表格数据的特征以提升预测性能。 -
多模态方法:
结合视网膜影像数据与其他临床参数(如氧疗时长、全身健康评分和遗传标志物),有望更全面地捕捉ROP的多因素特性(Gilbert等,2008;Smith等,2004)。多模态方法在医疗AI应用中日益普及,通过整合多样化数据模态展现出更优性能(Esteva等,2019;Hellström等,2001)。 -
多样化人群验证:
采用不同种族和地区人群数据集进行外部验证,对评估模型的稳健性和泛化能力至关重要。研究表明,各地区新生儿护理标准、成像方案及遗传易感性的差异会显著影响AI模型表现(García等,2024;Jalali等,2006)。建立多中心国际合作数据集有望解决此类挑战。 -
临床实践整合:
要将AI模型成功部署为临床决策支持工具,需对其准确性、可靠性和可解释性进行严格测试。与临床医生协作设计可操作的输出结果及用户友好界面,是推动临床落地的关键(Topol,2019)。近期可解释AI(XAI)技术的进展(如SHAP和Grad-CAM)可增强模型透明度,提升医疗从业者的信任度(Lundberg & Lee,2017;Selvaraju等,2017)。
5. 结论
本研究证明了机器学习模型(尤其是随机森林)在利用新生儿临床数据辅助ROP诊断方面的潜力。虽然该模型在灵敏度和特异性方面表现优异,但在特征选择、数据集质量和影像学数据整合等方面仍需改进,以实现临床转化。解决这些挑战有望开发出稳健且可扩展的方案,从而改善ROP筛查并降低儿童盲症负担。ROP诊断的未来在于结合临床见解与计算能力的多模态数据驱动方法,这将为个性化新生儿诊疗开辟新途径。
数据可用性
致谢
作者对"早产儿视网膜病变(ROP)及新生儿视网膜图像数据集"的创建者和贡献者(包括Timkovič、Hasal、Nowaková等研究者)致以诚挚谢意。他们在数据集采集与标注工作中付出了细致努力,这项由捷克共和国俄斯特拉发大学医院开展的成果为ROP筛查与诊断研究提供了宝贵资源。
数据可用性声明
本研究采用的"早产儿视网膜病变及新生儿视网膜图像数据集"为公开资源,获取方式详见原始文献:
- Timkovič, J., Nowaková, J., Kubíček, J., 等. (2024). 早产儿视网膜病变及新生儿视网膜图像数据集. Scientific Data, 11(814). https://doi.org/10.1038/s41597-024-03409-7
- Hasal, M., Nowaková, J., Hernández-Sosa, D., & Timkovič, J. (2022). 早产儿视网膜病变的图像增强技术. Lecture Notes in Networks and Systems, 527, 215–228. https://doi.org/10.1007/978-3-031-14627-5_43
8. 参考文献
[1] Aiello, L. P., Northrup, J. M., Keyt, B. A., et al. (1995). Hypoxic regulation of vascular endothelial growth factor in retinal cells. Archives of Ophthalmology, 113(12), 1538–1544.
[2] Alon, T., Hemo, I., Itin, A., Pe’er, J., Stone, J., & Keshet, E. (1995). Vascular endothelial growth factor acts as a survival factor for newly formed retinal vessels and has implications for retinopathy of prematurity. Nature Medicine, 1(10), 1024–1028. https://doi.org/10.1038/nm1095-1024
[3] Blencowe, H., Lawn, J. E., Vazquez, T., Fielder, A., & Gilbert, C. (2013). Preterm-associated visual impairment and estimates of retinopathy of prematurity at regional and global levels for 2010. Pediatric Research, 74(1), 35–49. https://doi.org/10.1038/pr.2013.60
[4] Chen, J., & Smith, L. E. H. (2007). Retinopathy of prematurity. Angiogenesis, 10(2), 133–140. https://doi.org/10.1007/s10456-007-9066-0
[5] Darlow, B. A., & Gilbert, C. E. (2013). Retinopathy of prematurity – A world update. Seminars in Perinatology, 37(2), 109–118. https://doi.org/10.1053/j.semperi.2013.02.004
[6] Flynn, J. T. (1983). Acute proliferative retrolental fibroplasia: Multivariate risk analysis. Transactions of the American Ophthalmological Society, 81, 549–591.
[7] Flynn, J. T., & Chan-Ling, T. (2006). Retinopathy of prematurity: Two distinct mechanisms that underlie zone 1 and zone 2 disease. American Journal of Ophthalmology, 142(1), 46–59. https://doi.org/10.1016/j.ajo.2006.02.053
[8] García, H., Villasis-Keever, M. A., Zavala-Vargas, G., Bravo-Ortiz, J. C., Pérez-Méndez, A., & Escamilla-Núñez, A. (2024). Global prevalence and severity of retinopathy of prematurity over the last four decades (1985–2021): A systematic review and meta-analysis. Archives of Medical Research, 55(2), 102967. https://doi.org/10.1016/j.arcmed.2024.102967
[9] Gilbert, C. (2008). Retinopathy of prematurity: A global perspective of the epidemics, population of babies at risk, and implications for control. Early Human Development, 84(2), 77–82. https://doi.org/10.1016/j.earlhumdev.2007.11.009
[10] Gilbert, C., Fielder, A., Gordillo, L., et al. (2008). Characteristics of infants with severe retinopathy of prematurity in countries with low, moderate, and high levels of development: Implications for screening programs. Pediatrics, 115(5), e518–e525. https://doi.org/10.1542/peds.2007-2444
[11] Hasal, M., Nowaková, J., Hernández-Sosa, D., & Timkovič, J. (2022). Image Enhancement in Retinopathy of Prematurity. Lecture Notes in Networks and Systems, 527, 215–228. https://doi.org/10.1007/978-3-031-14627-5_43
[12] Hasal, M., Pecha, M., Nowaková, J., Hernández-Sosa, D., Snášel, V., & Timkovič, J. (2023). Retinal Vessel Segmentation by U-Net with VGG-16 Backbone on Patched Images with Smooth Blending. Lecture Notes on Data Engineering and Communications Technologies, 182, 145–158. https://doi.org/10.1007/978-3-031-40971-4_44
[13] Hellström, A., Perruzzi, C., Ju, M., et al. (2001). Low IGF-I suppresses VEGF-survival signaling in retinal endothelial cells: Direct correlation with clinical retinopathy of prematurity. Proceedings of the National Academy of Sciences, 98(10), 5804–5808. https://doi.org/10.1073/pnas.101113998
[14] Jalali, S., Matalia, J., Hussain, A., & Anand, R. (2006). Modification of screening criteria for retinopathy of prematurity in India and other middle-income countries. American Journal of Ophthalmology, 141(5), 966–968. https://doi.org/10.1016/j.ajo.2005.11.016
[15] Ronneberger, O., Fischer, P., & Brox, T. (2015). U-Net: Convolutional networks for biomedical image segmentation. MICCAI 2015, 234–241. https://doi.org/10.1007/978-3-319-24574-4_28
[16] Smith, L. E. H., Shen, W., Perruzzi, C., et al. (1999). Regulation of vascular endothelial growth factor-dependent retinal neovascularization by insulin-like growth factor-1 receptor. Nature Medicine, 5(12), 1390–1395.
https://doi.org/10.1038/70954
[17] Terry, T. L. (1942). Extreme prematurity and fibroblastic overgrowth of persistent vascular sheath behind each crystalline lens: I. Preliminary report. American Journal of Ophthalmology, 25(2), 203–204.
[18] Timkovič, J., Nowaková, J., Kubíček, J., et al. (2024). Retinal Image Dataset of Infants and Retinopathy of Prematurity. Scientific Data, 11(814). https://doi.org/10.1038/s41597-024-03409-7
[19] Vinekar, A., Dogra, M. R., Sangtam, T., Narang, A., & Gupta, A. (2007). Retinopathy of prematurity in Asian Indian babies weighing greater than 1250 grams at birth: Ten-year data from a tertiary care center in a developing country. Indian Journal of Ophthalmology, 55(5), 331–336. https://doi.org/10.4103/0301-4738.33821
[20] Vinekar, A., Gilbert, C., Dogra, M., et al. (2014). The KIDROP model of combining strategies for providing retinopathy of prematurity screening in underserved areas in India using wide-field imaging, telemedicine, non-physician graders and smartphone reporting. Indian Journal of Ophthalmology, 62(1), 41–49. https://doi.org/10.4103/0301-4738.126179
版权说明:
本文由 youcans@xidian 对论文【Machine Learning Applications in Retinopathy of Prematurity Diagnosis Using the ROP Retinal Image Dataset】进行摘编和翻译。该论文版权属于原文期刊和作者,本译文只供研究学习使用。
youcans@xidian 作品,转载必须标注原文链接:
【医学影像 AI】机器学习在ROP诊断中的应用(https://youcans.blog.csdn.net/article/details/151358776)
Crated:2025-09
更多推荐
 已为社区贡献3条内容
已为社区贡献3条内容







所有评论(0)