单细胞+?才是文章顶流?
◉ 参与DNA甲基化和去甲基化基因的表达与胎盘发育候选印记的关联(DPPA5和AMPH):TPC1和TPC2中参与DNA去甲基化且高表达的基因(如AICDA基因)与候选印记基因DPPA5和AMPH的表达水平呈正相关。并利用猪以及胎盘基因注释完备的小鼠和人的单细胞数据进行验证。◉ 滋养层细胞为胎盘中最重要的细胞类型,因此进一步对滋养层细胞进行聚类分析,获得了12种不同的滋养层亚型,还鉴定出四种呈现阶
单细胞转录组是近年来科研领域的研究热点技术,不仅可以反应单细胞异质性,更能解析疾病相关的转录调控机制。然而,随着相关研究的爆发式增长,同质化问题日益凸显 —— 许多研究陷入 “细胞分群 - 标记基因鉴定 - 功能富集”的固定套路,创新不足导致高分文章难出,如何突破这一困境,让研究课题在海量研究中脱颖而出呢?
近期发表在的《Nature communications》的“Cell-cell communication-mediated cell-type-specific parent-of-origin effects in mammals”文章,为我们提供了极具启发性的破局思路。
该研究通过将猪的snRNA-seq数据与重测序数据相结合,重点分析了基因组印记基因在细胞类型和发育阶段的动态调控规律。

研究背景
基因组印记是指某些基因的表达仅来源于父源或母源拷贝,打破了常规的双等位基因表达模式。先前研究关于猪这一重要农业和医学模型中,确认的印记基因不足百个,且多数仅在胎盘中表现印记状态。因此,该研究通过构建高分辨率猪胎盘单细胞图谱,系统揭示了基因组印记基因在不同细胞类型和发育阶段中的动态调控规律。
研究思路
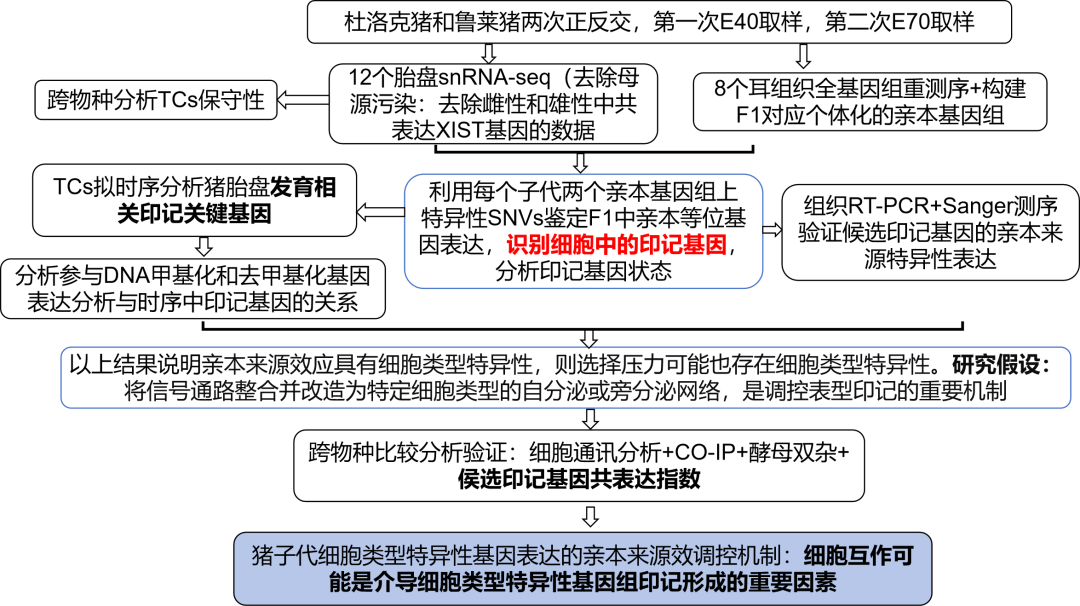
主要发现
1. 猪胎盘单细胞图谱(PCCA)显示发育中的猪胎盘广泛存在细胞异质性:
研究对猪F1胎盘进行snRNA-seq检测。
◉ 在E40(5.3w)和E70(5.2w)阶段总共获得了超过12w个细胞核图谱。鉴定出E40和E70阶段共有的五种主要细胞类型。
◉ 滋养层细胞为胎盘中最重要的细胞类型,因此进一步对滋养层细胞进行聚类分析,获得了12种不同的滋养层亚型,还鉴定出四种呈现阶段依赖性的细胞类型,并对两阶段细胞类型相似性进行了验证(AUROC≥0.95为高度相似)。
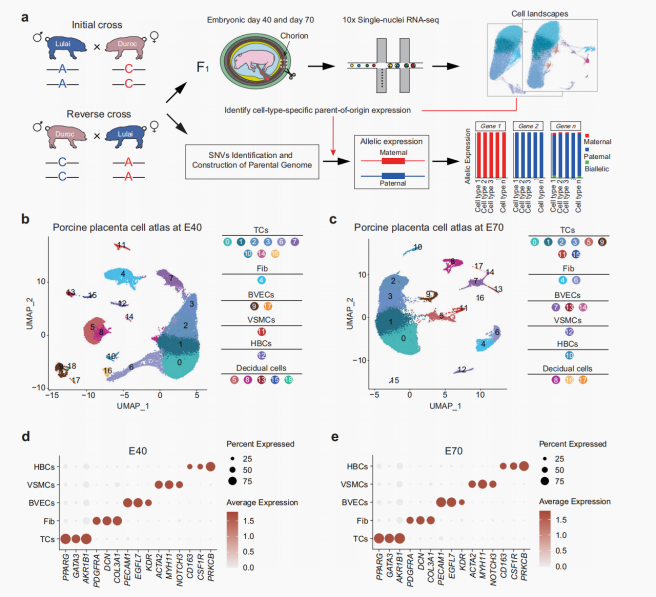
图.1|猪胎盘单细胞图谱的构建
2. 细胞类型特异性的基因组印记图谱:
利用snRNA-seq+重测序技术研究亲本来源效应在子代单细胞中基因的表达对胎盘发育的作用。
◉ 印记基因鉴定:共鉴定出118个候选印记基因,97个为哺乳动物的新印记基因,116个潜在候选基因。
◉ 各细胞类型中染色体候选印记基因的印记状态:近75%的印记候选基因呈现细胞类型与发育阶段双重依赖性表达模式。
◉ 无论已知还是候选印记基因,都在不同发育阶段相同细胞类型中会发生等位基因转换,说明他们在胎盘发育和功能中发挥着调控作用。
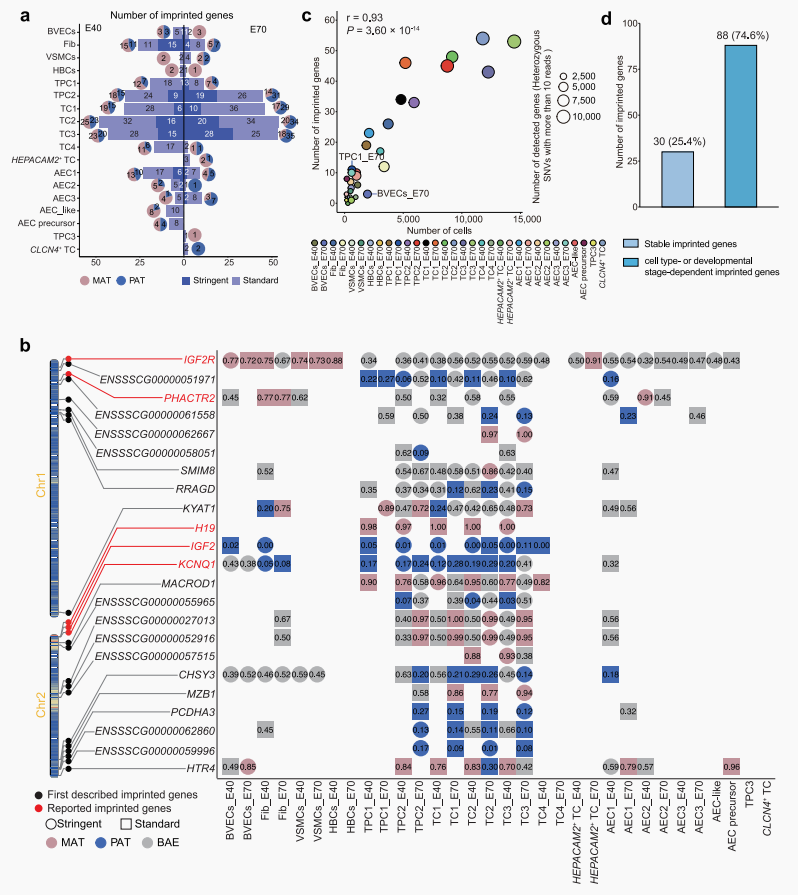
图.2|细胞类型特异性的基因组印记景观
3. 发现胎盘滋养层细胞发育相关关键印记基因:
进一步分析滋养层细胞中的基因组印记。
◉ 推断滋养层细胞分化轨迹:TPC1和TPC2均位于两个阶段的分化轨迹起点。但在不同发育阶段,它们与其他TCs亚型的连接模式发生了显著变化。
◉ TPC1和TPC2在两个阶段之间的DEGs:发现了在E40阶段更丰富且可能有助于胎盘滋养层发育的候选印记基因DPPA5和AMPH。
◉ 参与DNA甲基化和去甲基化基因的表达与胎盘发育候选印记的关联(DPPA5和AMPH):TPC1和TPC2中参与DNA去甲基化且高表达的基因(如AICDA基因)与候选印记基因DPPA5和AMPH的表达水平呈正相关。说明表观遗传可能影响偏向性等位基因表达。
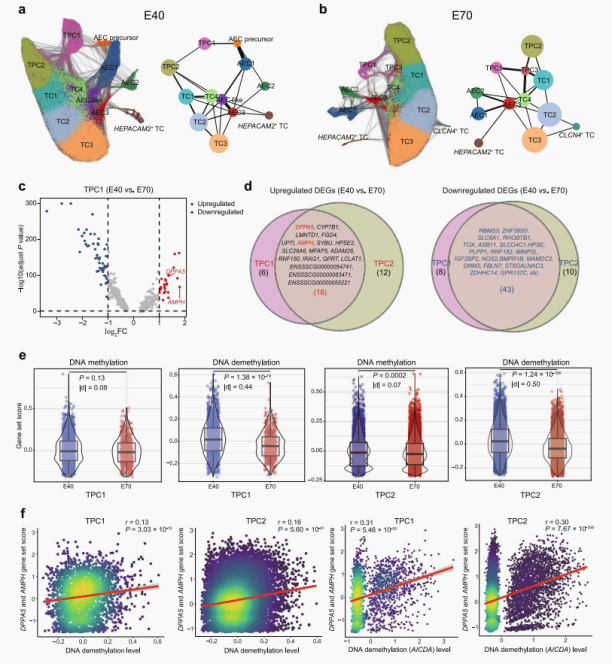
图.3|印记基因在滋养细胞发育中的作用
4. 跨物种分析揭示细胞间的通讯驱动细胞类型的等位基因表达:
上述结果表明亲本来源效应具有细胞类型依赖性,说明选择压力可能也存在细胞类型特异性。因此研究假设:哺乳动物将信号通路整合并改造为特定细胞类型的自分泌或旁分泌网络,是调控表型印记的重要机制。并利用猪以及胎盘基因注释完备的小鼠和人的单细胞数据进行验证。
◉ 细胞间通讯分析:猪和小鼠中发现,主要信号通路IGF中,IGF2配体和其受体IGF2R在其发生印记(偏向性表达)的细胞类型(BVECs、Fibs和VSMCs)中形成自分泌信号通路。而在人类的dM2中发现了IGF2配体和其受体IGF2R的自分泌网络,且在dM2中发现IGF2和IGF2R均表现出偏向性等位基因表达。说明印记基因形成自分泌网络具有细胞类型特异性。
◉ 验证互作:用STRING数据库预测所有印记基因的蛋白互作对,筛选一些进行CO-IP和酵母双杂验证,发现了直接互作对。
◉ 候选印记基因在两个阶段不同细胞类型中特异性的共表达水平:大多数基因-基因相互作用对以细胞类型特异性方式共表达。
◉ 小鼠和人的验证同样发现呈现细胞类型特异性的共表达特征。
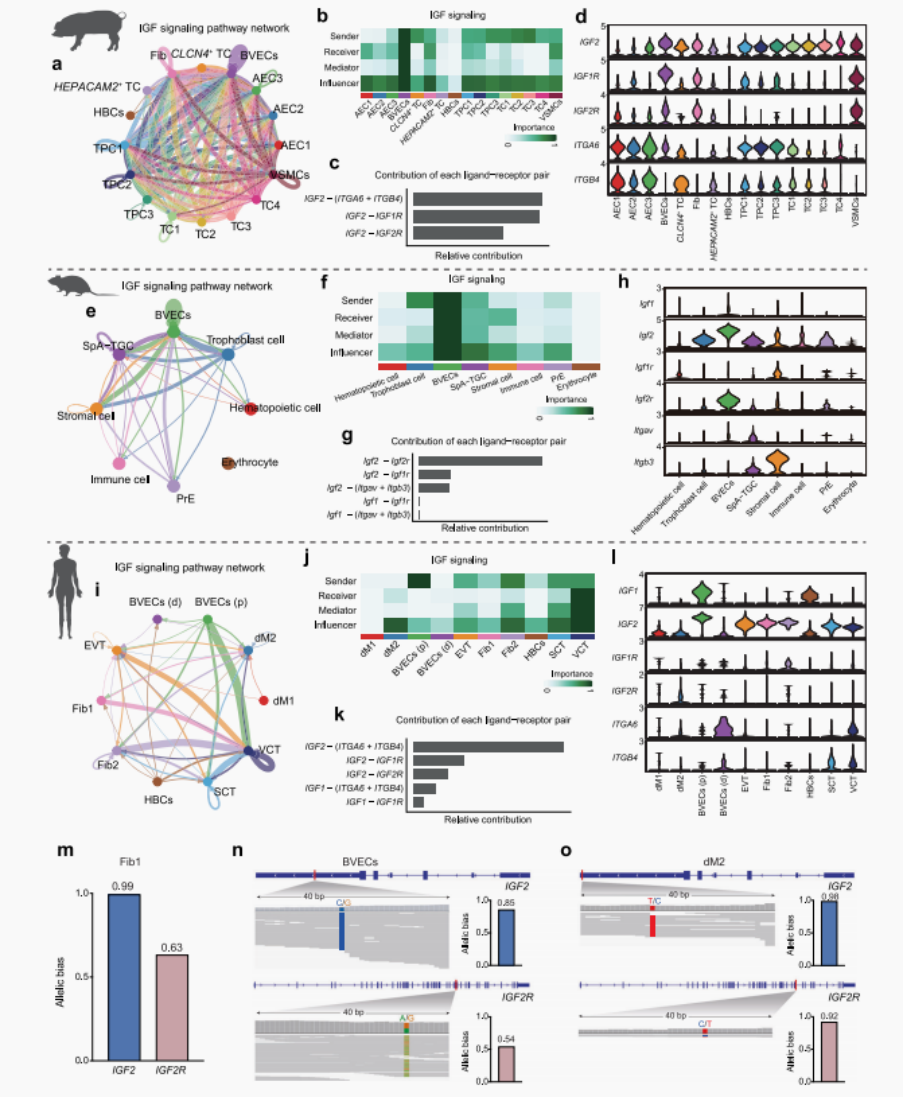
图.4|比较猪、小鼠和人类的细胞间通讯
研究结论
总之,该研究发现了胎盘发育相关印记基因,也说明了哺乳动物通过细胞间通讯,以特定细胞类型特异性的方式介导某些印记基因的偏向性等位基因表达。
读完这篇文章,是不是感觉自己的课题有新思路了?!已有的单细胞数据有用武之地了?!
凌恩 基于华大DNBelab C4单细胞平台搭建完善的单细胞项目流程,一站式满足样本制备到结果解读全流程,已经积累了丰富的单细胞(核)转录组项目经验!抓紧联xi哦!
参考文献
Wu JJ, et al. Cell-cell communication-mediated cell-type-specific parent-of-origin effects in mammals. Nat Commun. 2025 Jun 2;16(1):5106. doi: 10.1038/s41467-025-60469-y.
原文链接:
https://doi.org/10.1038/s41467-025-60469-y
更多推荐
 已为社区贡献1条内容
已为社区贡献1条内容






所有评论(0)