简介
该用户还未填写简介
擅长的技术栈
可提供的服务
暂无可提供的服务
英文名称:β-Amyloid (1-40);Aβ1-40中文名称:β- 淀粉样蛋白 (1-40);β- 淀粉样肽 (1-40)单字母序列:DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVV。
Aβ25-35 保留了全长 Aβ 的核心毒性结构,可通过聚集形成寡聚体,引发神经元氧化应激、钙稳态失衡、线粒体功能障碍及凋亡通路激活;其序列保守且易合成,能快速模拟全长 Aβ 的致病性,大幅降低实验成本与难度,成为 AD 研究的简化模型。
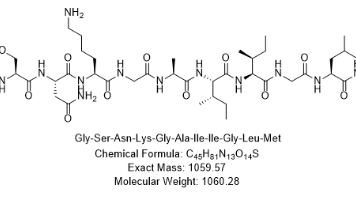
大鼠 Aβ1-40 的氨基酸序列与人类 Aβ1-40 高度同源(95% 一致性),但关键位点突变导致其聚集能力与毒性显著降低;利用该特性,可在大鼠模型中模拟 Aβ 沉积的病理过程,同时通过对比人类 Aβ1-42 的作用,明确物种间 Aβ 病理效应的差异,为抗 AD 药物的临床前筛选提供更贴近人类病理的参考依据。
Aβ42-1 与天然 Aβ1-42 的氨基酸组成、分子量完全一致,但序列方向相反导致核心疏水聚集域(LVFFA)被极性残基分隔,无法形成连续的疏水核心及稳定的分子间 π-π 堆积,因此不具备天然 Aβ1-42 的聚集能力与神经毒性。,可精准验证天然 Aβ1-42 的聚集是否依赖特定氨基酸排列顺序,同时为反向肽抑制剂的设计提供结构依据。
Aβ42-1 与天然 Aβ1-42 的氨基酸组成、分子量完全相同,但序列方向相反,导致分子内氢键网络、疏水区域排布与天然 Aβ1-42 存在本质差异 —— 天然 Aβ1-42 的核心疏水聚集域(LVFFA)呈连续排列,而 Aβ42-1 的疏水残基被极性残基分隔,无法形成稳定的 β- 折叠结构与聚集核心。,精准区分天然 Aβ1-42 的序列特异性聚集与非特异性聚集,同时用于开发反向肽类抑制剂。
人胰淀素酰胺含核心疏水聚集域(NFGAILS),该区域是驱动肽段形成 β- 折叠结构、组装为淀粉样纤维的关键单元;生理状态下,胰淀素与胰岛素以 1:10 的比例共分泌,胰岛素可通过分子间相互作用抑制胰淀素聚集;病理状态下,胰岛素分泌不足或胰淀素过表达打破平衡,胰淀素通过疏水核心的 π-π 堆积与分子间氢键形成纤维聚集体,损伤胰岛 β 细胞。该肽段可复现 2 型糖尿病中胰淀素的病理聚集过程,是相关研